Persamaan linear
adalah sebuah persamaan aljabar, yang tiap sukunya merupakan konstanta, atau perkalian konstanta dengan variabel tunggal. Persamaan ini dikatakan linear sebab mereka digambarkan dalam garis lurus di koordinat Kartesius.
Bentuk umum untuk persamaan linear adalah
Contoh sistem persamaan linear dua variabel:
 ,
,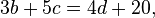 ,
,
[sunting] Sistem Persamaan Linear Dua Variabel
Persamaan linear yang rumit, seperti di sebut di atas, bisa ditulis dengan menggunakan hukum aljabar agar menjadi bentuk yang lebih sederhana. Seperti contoh, huruf besar di persamaan merupakan konstanta, dan x dan y adalah variabelnya.
[sunting] Bentuk Umum
-
- dimana konstanta A dan B bila dijumlahkan, hasilnya bukan angka nol. Konstanta dituliskan sebagai A ≥ 0, seperti yang telah disepakati ahli matematika bahwa konstanta tidak boleh sama dengan nol. Grafik persamaan ini bila digambarkan, akan menghasilkan sebuah garis lurus dan setiap garis dituliskan dalam sebuah persamaan seperti yang tertera diatas. Bila A ≥ 0, dan x sebagai titik potong, maka titik koordinat-xadalah ketika garis bersilangan dengan sumbu-x (y = 0) yang digambarkan dengan rumus -c/a. Bila B≥ 0, dan y sebagai titik potong, maka titik koordinat- y adalah ketika garis bersilangan dengan sumbu-y (x = 0), yang digambarkan dengan rumus -c/b.
[sunting] Bentuk standar
-
- dimana, A dan B jika dijumlahkan, tidak menghasilkan angka nol dan A bukanlah angka negatif. Bentuk standar ini dapat dirubah ke bentuk umum, tapi tidak bisa diubah ke semua bentuk, apabila A dan B adalah nol.
[sunting] Bentuk titik potong gradien
[sunting] Sumbu-y
-
- dimana m merupaka gradien dari garis persamaan, dan titik koordinat y adalah persilangan dari sumbu-y. Ini dapat digambarkan dengan x = 0, yang memberikan nilai y = b. Persamaan ini digunakan untuk mencari sumbu-y, dimana telah diketahui nilai dari x. Y dalam rumus tersebut merupakan koordinat y yang anda taruh di grafik. Sedangkan X merupakan koordinat x yang anda taruh di grafik.
[sunting] Sumbu-x
-
- dimana m merupakan gradien dari garis persamaan, dan c adalah titik potong-x, dan titik koordinat x adalah persilangan dari sumbu-x. Ini dapat digambarkan dengan y = 0, yang memberikan nilai x = c. Bentuk y/m dalam persamaan sendiri berarti bahwa membalikkan gradien dan mengalikannya dengan y. Persamaan ini untuk mencari titik koordinat x, dimana nilai y sudah diberikan.
ء-Sistem persamaan linear lebih dari dua variabel
Sebuah persamaan linear bisa lebih dari dua variabel, seperti berikut ini:
dimana dalam bentuk ini, digambarkan bahwa a1 adalah koefisien, x dan n merupakan variabel dan b adalah konstanta।
Reaksi kimia adalah suatu proses alam yang selalu menghasilkan antarubahan senyawa kimia.[1]
Beragamnya reaksi-reaksi kimia dan pendekatan-pendekatan yang dilakukan dalam mempelajarinya mengakibatkan banyaknya cara untuk mengklasifikasikan reaksi-reaksi tersebut, yang sering kali tumpang tindih. Di bawah ini adalah contoh-contoh klasifikasi reaksi kimia yang biasanya digunakan.
- Isomerisasi, yang mana senyawa kimia menjalani penataan ulang struktur tanpa perubahan pada kompoasisi atomnya
- Kombinasi langsung atau sintesis, yang mana dua atau lebih unsur atau senyawa kimia bersatu membentuk produk kompleks:
- Dekomposisi kimiawi atau analisis, yang mana suatu senyawa diurai menjadi senyawa yang lebih kecil:
- Penggantian tunggal atau substitusi, dikarakterisasikan oleh suatu unsur digantikan oleh unsur lain yang lebih reaktif:
- Metatesis atau Reaksi penggantian ganda, yang mana dua senyawa saling berganti ion atau ikatan untuk membentuk senyawa yang berbeda:
- Reaksi asam basa, secara luas merupakan reaksi antara asam dengan basa. Ia memiliki berbagai definisi tergantung pada konsep asam basa yang digunakan. Beberapa definisi yang paling umum adalah:
- Definisi Arrhenius: asam berdisosiasi dalam air melepaskan ion H3O+; basa berdisosiasi dalam air melepaskan ion OH-.
- Definisi Brønsted-Lowry: Asam adalah pendonor proton (H+) donors; basa adalah penerima (akseptor) proton. Melingkupi definisi Arrhenius.
- Definisi Lewis: Asam adalah akseptor pasangan elektron; basa adalah pendonor pasangan elektron. Definisi ini melingkupi definisi Brønsted-Lowry.
- Reaksi redoks, yang mana terjadi perubahan pada bilangan oksidasi atom senyawa yang bereaksi. Reaksi ini dapat diinterpretasikan sebagai transfer elektron. Contoh reaksi redoks adalah:
- 2 S2O32−(aq) + I2(aq) → S4O62−(aq) + 2 I−(aq)
- Yang mana I2 direduksi menjadi I- dan S2O32- (anion tiosulfat) dioksidasi menjadi S4O62-.
- Pembakaran, adalah sejenis reaksi redoks yang mana bahan-bahan yang dapat terbakar bergabung dengan unsur-unsur oksidator, biasanya oksigen, untuk menghasilkan panas dan membentuk produk yang teroksidasi. Istilah pembakaran biasanya digunakan untuk merujuk hanya pada oksidasi skala besar pada keseluruhan molekul. Oksidasi terkontrol hanya pada satu gugus fungsi tunggal tidak termasuk dalam proses pembakaran.
1. Prinsip Aufbau : elektron-elektron mulai mengisi orbital dengan tingkat energi terendah dan seterusnya.
Contoh pengisian elektron-elektron dalam orbital beberapa unsur:
Atom H : mempunyai 1 elektron, konfigurasinya 1s1
Atom C : mempunyai 6 elektron, konfigurasinya 1s2 2s2 2p2
Atom K : mempunyai 19 elektron, konfigurasinya 1s2 2s2 2p6 3S2 3p6 4s1
2. Prinsip Pauli : tidak mungkin di dalam atom terdapat 2 elektron dengan keempat bilangan kuantum yang sama.
Hal ini berarti, bila ada dua elektron yang mempunyai bilangan kuantum utama, azimuth dan magnetik yang sama, maka bilangan kuantum spinnya harus berlawanan.
3. Prinsip Hund : cara pengisian elektron dalam orbital pada suatu sub kulit ialah bahwa elektron-elektron tidak membentuk pasangan elektron sebelum masing-masing orbital terisi dengan sebuah elektron.
Contoh:
- Atom C dengan nomor atom 6, berarti memiliki 6 elektron dan cara Pengisian orbitalnya adalah:
- LAMBANG UNSUR-UNSUR GOLONGAN A
Lambang Golongan Nama Golongan Konfigurasi Elektron Orbital Terluar
I – A Alkali ns1
II – A Alkali tanah ns2
III – A Boron ns2 – np1
IV – A Karbon – Silikon ns2 – np2
V – A Nitogen – Posphor ns2 – np3
VI – A Oksigen ns2 – np4
VII – A Halogen ns2 – np5
VIII – A Gas mulia ns2 – np6
- LAMBANG UNSUR-UNSUR GOLONGAN B
Konfigurasi Elektron Lambang Golongan
(n – 1) d1 ns2 III – B
(n – 1) d2 ns2 IV – B
(n – 1) d3 ns2 V – B
(n – 1) d4 ns2 VI – B
(n – 1) d5 ns2 VII – B
(n – 1) d6-8 ns2 VIII
(n – 1) d9 ns2 I – B
(n – 1) d10 ns2 II – B
- GOLONGAN LANTANIDA DAN AKTINIDA, DIBERI LAMBANG nS2 (n-2)f1-14
Jika :
n = 6 adalah lantanida
n = 7 adalah aktinida
IKATAN HIDROGEN
Ikatan ini merupakan gaya tarik menarik antara atom H dengan atom lain yang mempunyai keelektronegatifan besar pada satu molekul dari senyawa yang sama.
Contoh:
- moleku
- molekul हफ











